Попередня сторінка: 4. A kémiai elem jellegének, egyszerű és összetett vegyületei tu...
Наступна сторінка: 6. Akovalens kötés. Molekuláris és atomrács-szerkezetű anyagok
E téma tananyaga segít nektek:
felidézni az ionos kötés jellemzőit;
tisztázni az ionos kötés erősségének függését az
ion sugarától és töltésétől;
megérteni az ionos kötés és az ionvegyületek tulajdonságai közötti összefüggést.
Az ionok. Már tudjátok, hogy az atomok elektronleadással vagy -felvétellel elektromosan töltött részecskéket, ionokat képeznek. A pozitív, illetve a negatív ionok képződésének példája:

Emlékezzetek vissza, hogyan nevezik a pozitív töltésű ionokat és hogyan a negatív töltésűeket?
Az ionok lehetnek egyszerűek és összetettek. Az egyszerű ionok egyféle kémiai elemből állnak:
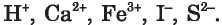
Az összetett ionokat legalább két különböző elem alkotja:
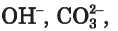
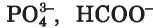
az atomok bennük kovalens kötéssel kapcsolódnak egymáshoz.
Nagyon sok összetett ionra Jellemző a szimmetrikus szerkezet Az NO3- nitrát-ion és a COf- - karbonát-ion (3. a ábra) formája szabályos háromszög, melynek középpontjában a nitrogén vagy a szénatom található, és a háromszög sarkaiban három oxi-
génatom helyezkedik el. Az SOj~ szulfát-ion és a PO4 foszfát-ion (3. b ábra) tonnája a CH4 képletű metánmolekulára hasonlít Ezek az ionok tetraéderes szerkezettel rendelkeznek, melynek középpontjában savképző elem található, a négy csúcsban pedig oxigén-atomok.

Az ionos kötés. Az ellentétes töltésű ionok között elektrosztatikus vonzóerő lép fel. Ezt a kölcsönhatást ionos kötésnek nevezzük. Ez valósul meg a bázisképző és az amfoter oxidokban, a lúgokban, a szervetlen és a szerves savak sóiban, egyéb bináris vegyületekben, melyek fémes és nemfémes elemet tartalmaznak. Példa az ionos vegyületekre:


Az ionok elég erősen kötődnek egymáshoz. Az ellentétes töltésű ionok szétválasztása jelentős energiaráfordítást igényel. Minél nagyobb az ionok töltése és minél kisebb a távolság közöttük (vagyis minél kisebb a kation és az anion sugara), annál erősebb az ionos kötés a vegyü-letben. Ez a fizikából tanult Coulomb törvényből következik, ami az elektromos töltések kölcsönhatásának nagyságát határozza meg. Az ion töltésének növekedésével megnő az ionkötés erőssége, amit a vegyület olvadáspontja bizonyít:

Hozzá kell tennünk, hogy a
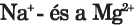
-kationok,
valamint a F ~ - és az

-anionok méretükben nem sokat különböznek, töltésük viszont kétszer nagyobb.
A fluorhidrogén-sav sóinak magasabb az olvadáspontja, mint a megfelelő kloridoknak. így például a nátrium-klorid (NaC) +801 0C hőmérsékleten olvad, a nátrium-fluorid (NaF) pedig 996 °C-on. Ez az anionok méretének különbözőségével magyarázható. A FMon mérete kisebb, mint a Cl'-ioné, ezért a fluoridokban erősebb az ionkötés.
Az ionvegyületek. Az ionvegyületek szilárd halmazállapotúak, rendszerint kristályos anyagok (4. ábra). A kötés erőssége miatt általában kemények, olvadáspontjuk magas.
Az egyszeres töltésű kationokat és anionokat tartalmazó sók (pl. CH3COONa, KNO3, LiI)

4. ábra
Kősókristály és a modellje
többsége vízben oldódik. A kétszeres töltésű kationokat és anionokat tartalmazó sók közül a szulfátok (egy-két kivétellel) és néhány más sav sója oldódik vízben. Vízben oldódó háromszoros töltésű kationokat és anionokat tartalmazó sók nem ismeretesek (lásd az oldhatósági táblázatot a tankönyv hátsó előzékén).
Az ionvegyületek vízben való oldódásánál az oldatba az anyagot felépítő ionok kerülnek. Az elektrolitos disszociáció teljesen végbemegy, mivel az anyag erős elektrolit. Ilyen esetekben az elektrolitos disszociáció egyenleténél nem a visszafordíthatóság, hanem az egyenlőség jelét használjuk:
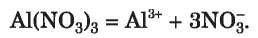
Az ionvegyületeket jellemezve, ami ionok halmazából áll, tapasztalati képletet alkalmaznak. A tapasztalati képletben az alsó index az összetevők legegyszerűbb arányát fejezi ki, vagyis az ionképlet nem az ionok számát mutatja, hanem az ionrácsban levő kationok és anionok számarányát jelzi. így például a líti-um-oxid, melynek tapasztalati képletéből Li2O megtudhatjuk, hogy a Li+ és az O2' aránya 2:1; a magnézium-foszfát
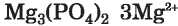
-ion- és
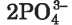
-ion-komplexet tartalmaz, vagyis a kationok és az anionok aránya 3:2.
Szerkezeti képletet nem írunk az ionvegyüle-teknek, mert az a kovalens kötésre jellemző.
ÖSSZEFOGLALÁS
Az ionkötés ellentétes töltésű ionok között alakul ki. Ilyen kötés jellemző a bázisképző és az amfoter oxidokra, a lúgokra, a sókra.
Az ionkötés erős elsődleges kötés. Az ionrácsos anyagokra jellemző a magas olvadáspont. Az ionvegyületek többsége vízben oldódik; az oldatban a vegyület ionokra disszociál.
37. írjátok fel az oxigén és a kálium ionjainak kémiai képletét és elektronszerkezetét.
38. Milyen ionok képződhetnek a hidrogén-, a bróm- és a vasatomokból? Határozzátok meg, felvesznek vagy leadnak elektront ezek az atomok, és milyen mennyiségben?
39. Az alábbi sémákban írjátok be az odaillő plusz vagy mínusz jelet és a megfelelő elektronszámot:

40. Magyarázzátok meg, hogy amikor a halogénelemek egyszerű iont alkotnak, miért anion keletkezik és nem kation.
41. Szerkezetükre alapozva adjatok meghatározást a lúgoknak és a sóknak.
42. írjátok fel azokat a kémiai képleteket, amelyek ionos anyagoknak felelnek meg: BaCl2, SO3, CH4, Mg(OH)2, HNO3, ZnO, (CH3COO)2Ca, C2H5OH.
43. Állítsátok össze azoknak a vegyületeknek a képleteit, melyeket a felsorolt ionok alkotnak:
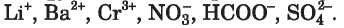
44. Miért nincs szaguk az ionvegyületeknek?
45. Véleményetek szerint az alábbi anyagok közül melyiknek magasabb az olvadáspontja:
a) a lítium-oxidnak vagy a nátrium-szulfidnak;
b) a kálium-fluoridnak vagy a kalcium-oxidnak?
Válaszotokat támasszátok alá érvekkel, és bizonyítsátok az interneten található adatokkal.
46. Mivel magyarázható, hogy a vízben oldódó fluoridok száma kevesebb a vízben oldódó kloridokénál?
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 6. Akovalens kötés. Molekuláris és atomrács-szerkezetű anyagok